| Autor |
Nachricht |
SoulRaiZor
Gast
|
 SoulRaiZor Verfasst am: 02. Okt 2010 13:27 Titel: Mischtemperatur Berechnen SoulRaiZor Verfasst am: 02. Okt 2010 13:27 Titel: Mischtemperatur Berechnen |
 |
|
Hallo!
Ich habe folgende Aufabe:
In ein Gefäß mit mw=1kg Wasser von 30°C wird me=100g Eis von 0°C gegeben.
a; Berechnen Sie die Mischtemperatur
Lösungsansatz:
Die Mischtemperatur stellt sich ja zwischen beiden Temperaturen ein.
Daraus folgt Twasser=30°C-Tmisch
und Teis=0°C+Tmisch
Qauf=Qab
Nun habe ich die Gleichungen aufgestellt:
Qauf= cwasser * mw * Twasser
=4,168(kJ/kg*K) * 1kg * (30°C - Tmisch)
Als erstes muss Eis in Wasser umgewandelt werden:
qsch*meis
Qab=qsch * me + cwasser * me * (0°C + Tmisch)
Dann habe ich die Gleichungen gleich gesetzt und berechnet.
Doch da kommt nichts gescheites raus.
Liegt es an der Grundüberlegung, oder rechne ich falsch?
Als Ergebnis erhalte ich Tmisch=-1,6kJ + 28,55°C
Das muss falsch sein.
Vielen Dank,
SoulRaiZor |
|
 |
fuss

Anmeldungsdatum: 25.05.2010
Beiträge: 519
|
 fuss Verfasst am: 02. Okt 2010 22:06 Titel: fuss Verfasst am: 02. Okt 2010 22:06 Titel: |
 |
|
von der Einheit her kann im Ergebnis für T kein Joule mehr vorkommen.
Theoretisch würde das in deiner Rechnung trotzdem wegfallen, weil die ist im Grunde richtig, du hast also irgendwo einen Rechenfehler drin (oder du hast das mit dem Joule aus Versehen hingeschrieben, hab dein Ergebnis nicht nachgerechnet).
Zusätzlich möchte ich dir aber noch formale Hinweise geben:
Ersteinmal: Ist zwar für die Rechnung egal, aber Qauf würde ich Eis zuordnen (Eis nimmt Wärme auf) und Qab Wasser (Wasser gibt Wärme ab).
Außerdem pass auf, dass °C eigentlich nicht als T angegeben wird (das T wird üblicherweise in Kelvin angegeben), sondern als 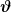
Für die aufgenommene Wärme von 0°C Wasser (geschmolzenes Eis) musst du beachten, dass die Temperaturdifferenz als Differenz angegeben wird, also nicht:
0°C+Mischtemp, sondern Mischtemp.-0°C
Das ist bei dir trotz dem Pluszeichen bei der Temperaturdifferenz noch richtig, weil Mischtemp.-0 ist gleich Mischtemp.+0
Bei Wasser heißt es dann 30°C-Mischtemp., wie du auch schon geschrieben hast |
|
 |
SoulRaiZor
Gast
|
 SoulRaiZor Verfasst am: 03. Okt 2010 11:32 Titel: SoulRaiZor Verfasst am: 03. Okt 2010 11:32 Titel: |
 |
|
Gerechnet habe ich nun mal mit folgenden Werten:
 +337\frac{kJ}{kg}*0,1kg )
)
dann wird das gleichgesetzt:
 +337\frac{kJ}{kg}*0,1kg = 4,168\frac{kJ}{kg*K} *1kg*(303K-T_{misch}))
weiter vereinfacht:
+33,7kJ=4,168*(303K-T_{misch} ))
Klammern aufgelöst:
57,33kJ+0,21\frac{kJ}{K} *T_{misch} +33,7kJ=1263kJ-4,168\frac{kJ}{K} *T_{misch}
wieder vereinfacht:

Ergebnis:

das ist wohl nicht möglich...
ich versteh nicht, was ich falsch mache.
mfg |
|
 |
GvC
Anmeldungsdatum: 07.05.2009
Beiträge: 14861
|
 GvC Verfasst am: 03. Okt 2010 14:59 Titel: GvC Verfasst am: 03. Okt 2010 14:59 Titel: |
 |
|
|
Dein Fehler liegt in der ersten Zeile. Da muss die Temperaturdifferenz Tmisch-273K stehen. |
|
 |
magician4
Anmeldungsdatum: 03.06.2010
Beiträge: 914
|
 magician4 Verfasst am: 03. Okt 2010 15:02 Titel: magician4 Verfasst am: 03. Okt 2010 15:02 Titel: |
 |
|
dein fehler liegt darin, dass du die spez. waermekapazitaet von eis (2.1 kJ/kg*K) heranziehst statt der schmelzenthalpie (333.5 kJ/kg) , daher auch deine "komische" einheit
das schmelzen geschieht jedoch isotherm (und natuerlich auch isobar)
berechnungsweg:
- berechnen der schmelzenthalpie von 100 g eis --> 100 g wasser (bei isotherm 0°C) ( wert hab ich dir oben ja gegeben)
- abkuehlen deines fluessigen wassers, 1 kg, 30°C, mit eben diesem energie-entzug (tabelle zur spez. waermekapazitaet in diesem temperaturbereich: http://www.wissenschaft-technik-ethik.de/wasser_eigenschaften.html#kap04)
--> neue (geringere) temperatur deiner "1 kg heiss-phase"
- mischen von 1 kg " abgekuehlten heisswassers, fl." mit 100 g wasser, fluessig, 0°C --> mischtemperatur
(mal schnell und schmutzig ueberschlagen kommt dann irgendwas bei 19°C raus)
alles klar?
gruss
ingo |
|
 |
SoulRaiZor
Anmeldungsdatum: 03.10.2010
Beiträge: 3
|
 SoulRaiZor Verfasst am: 03. Okt 2010 15:20 Titel: SoulRaiZor Verfasst am: 03. Okt 2010 15:20 Titel: |
 |
|
so nun habe ich Tmisch abgeändert und berechnet, nun komme ich auf 11,02°C
die 2,1 wurden auch durch 4,168 getauscht.
es müssten aber 20.04°C rauskommen...
ich bin am verzweifeln.
mfg |
|
 |
magician4
Anmeldungsdatum: 03.06.2010
Beiträge: 914
|
 magician4 Verfasst am: 03. Okt 2010 15:26 Titel: magician4 Verfasst am: 03. Okt 2010 15:26 Titel: |
 |
|
deine "20.04" liegen verdammt nahe an meinen "schnell und schmutzig:~ 19"
versuchs doch mal mit meinem weg...
..dann klappts vermutlich auch mittm ergebnis
gruss
ingo |
|
 |
SoulRaiZor
Anmeldungsdatum: 03.10.2010
Beiträge: 3
|
 SoulRaiZor Verfasst am: 03. Okt 2010 16:50 Titel: SoulRaiZor Verfasst am: 03. Okt 2010 16:50 Titel: |
 |
|
bei deinem Weg steig ich nicht durch, sonst würde ichs versuchen.
mfg |
|
 |
magician4
Anmeldungsdatum: 03.06.2010
Beiträge: 914
|
 magician4 Verfasst am: 03. Okt 2010 18:29 Titel: magician4 Verfasst am: 03. Okt 2010 18:29 Titel: |
 |
|
schmelzenthalpie eis = 337 kJ/kg (dein wert)
--> 100 g eis brauchen um bei 0°C zu schmelzen 33,7 kJ
diese energie kommt aus dem heissen, fluessigen wasser
wieviel kuehlen sich 1000g wasser von ausgangs 30°C ab, wenn ihnen 33,7 kJ entzogen werden?
spez. waermekapazitaet in diesem bereich: 4.168 kJ/kg*K
--> die 1000 g wasser kuehlen sich um 8.085 grad ab
--> die neue temperatur dieser 1000 g betraegt 21.915 °C
welche mischtemperatur bekommst du wenn du 100 g wasser, 0°C (= 273 K , dein wert) mit 1000 g wasser, 21.915 °C ( 294.915 K) mischt?
Tmisch= (T1*m1 + T2*m2 )/(m1+m2) , T in kelvin
--> bei mir sinds 19.92 °C
die differenz zu deinem ergebnis duerfte irgendwo in unterschiedlichem runden liegen
gruss
ingo |
|
 |
SoulRaiZor
Anmeldungsdatum: 03.10.2010
Beiträge: 3
|
 SoulRaiZor Verfasst am: 04. Okt 2010 19:06 Titel: SoulRaiZor Verfasst am: 04. Okt 2010 19:06 Titel: |
 |
|
Hallo!
Danke für die Hilfe, nun hats geklappt!
mfg
SoulRaiZor |
|
 |
|















